Активные центры ферментов

Ферменты действуют только при прямом контакте с превращающимся субстратом, поэтому необходимой стадией процесса, катализируемого ферментом (ферментативного превращения), является образование комплекса фермента с субстратом или субстратами. В комплексе белок-фермент различают активный центр (А), т. е. место в пространственной структуре фермента, с которым связывается субстрат (5) (рис. 4.2… Читать ещё >
Активные центры ферментов (реферат, курсовая, диплом, контрольная)
Ферменты действуют только при прямом контакте с превращающимся субстратом, поэтому необходимой стадией процесса, катализируемого ферментом (ферментативного превращения), является образование комплекса фермента с субстратом или субстратами. В комплексе белок-фермент различают активный центр (А), т. е. место в пространственной структуре фермента, с которым связывается субстрат (5) (рис. 4.2). Селективность действия ферментов определяется высокой избирательной способностью субстрата узнавать его активный центр. Часть активного центра, ответственного за селективное связывание, иногда называют адсорбционным центром фермента. Ту часть активного центра, которая принимает непосредственное участие в каталитическом процессе, называют каталитическим центром. Эти два центра могут перекрываться.
Кроме активного центра, у ферментов имеется регуляторный (аллостерический) центр, который в молекуле фермента пространственно разделен с активным центром. Вещества, связывающиеся с аллостерическим центром, называют аллостерическими эффекторами. Они через аллостерический центр влияют на функцию активного центра. Аллостерические эффекторы называются либо положительными (активаторы), либо отрицательными (ингибиторы).
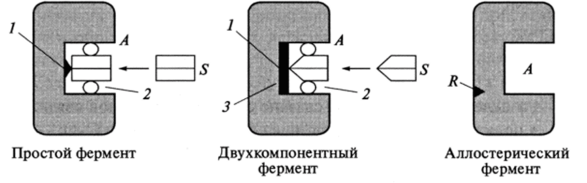
Рис. 4.2. Схематическое изображение ферментных структур:
А — активный центр; S — субстрат; R — регуляторный или аллостерический центр; 1 — каталитический участок; 2 — контактные участки; 3 — кофактор (кофермент) Обычно активный центр фермента образуется из 12−16 аминокислотных остатков полипептидной цепи. Аминокислоты, формирующие активный центр, находятся в разных местах полипептидной цепи, нередко на противоположных концах. При пространственной укладке они сближаются и образуют активный центр.
Примерно треть аминокислот ферментного белка прямо или косвенно участвует в работе активного центра. У простых ферментов роль функциональных групп контактного и каталитического участков активного центра выполняют только боковые радикалы аминокислот. У сложных ферментов главную роль в этих процессах выполняют кофакторы.
В катализе принимают участие следующие функциональные группы ферментов:
- • СООН-группы дикарбоновых аминокислот и концевые СООН-группы полипептидной цепи;
- • NH2-rpynnbi лизина и концевые ЫН2-группы полипептидной цепи;
- • гуанидиновые группы аргинина;
- • индольные триптофана;
- • имидазольные гистидина;
- • ОН-группы серина и треонина;
- • SH-группы цистеина и дисульфидные цистина;
- • тиоэфирные группы метионина;
- • фенольные группы тирозина;
- • гидрофобные цепи алифатических аминокислот и ароматическое кольцо фенилаланина.
Например, фермент панкреатическая рибонуклеаза катализирует двустадийный гидролиз фосфодиэфирных связей в РНК, сходный в общих чертах со щелочным гидролизом этих связей. На первой стадии происходит внутримолекулярная атака атома Р на 2'-ОН-группу примыкающей со стороны З'-кислородного атома остатка рибозы с образованием циклического 2', 3'-фосфата и разрывом межнуклеотидной связи. На второй стадии происходит гидролиз пятичленного фосфодиэфирного цикла.
Процесс, изображенный ниже, представляет пример гидролиза одного из простейших субстратов рибонуклеазы — уридилил-(3 '->5')-аденозина.
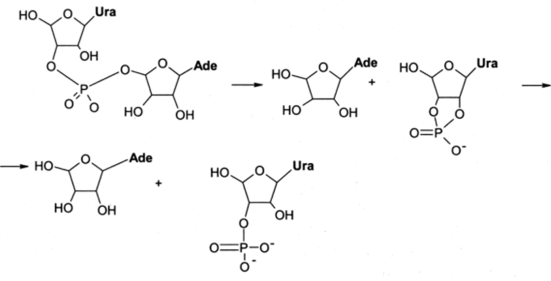
Белок, который в данном случае сам по себе является ферментом и не требует участия дополнительных кофакторов, выполняет две главные функции: узнает специфичный субстрат, ориентируя его в составе комплекса нужным образом относительно имидазольных колец двух остатков гистидина, и осуществляет с помощью этих двух остатков, формирующих каталитический центр фермента, общий кислотный и основной катализ на обеих стадиях гидролиза. Эти функции — наиболее общие для всех белков, являющихся ферментами или входящими в их состав.
Помимо кислотно-основного катализа белки в отдельных случаях могут осуществлять нуклеофильный катализ.
Используя математическую символику, общее строение ферментов можно представить следующим образом: 