Дихроматометрическое титрование.
Дихроматометрическое титрование

Применение дихроматометрии. Прямым дихроматометрическим титрованием можно определять ряд восстановителей, таких, как железо (II) (включая определение ферроцианидов, содержащих ферроцианид-ион4?), сульфиты, иодиды, арсениты, аскорбиновую кислоту, метанол, суммы окисляющихся веществ в воде и почве и т. д. Методом обратного титрования определяют некоторые окислители. Так, определение железа (II… Читать ещё >
Дихроматометрическое титрование. Дихроматометрическое титрование (реферат, курсовая, диплом, контрольная)
Дихроматометрическое титрование — титриметрический метод анализа, основанный на применении в качестве титранта K2Cr2O7.
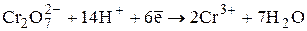
E0 = +1,33 В Стандартный раствор K2Cr2O7 является первичным. Он устойчив при хранении. В отличие от KMnO4 дихромат не восстанавливается следами органических веществ и хлорид-ионов, содержащихся в воде. Для обнаружения конечной точки титрования обычно используют окислительно-восстановительные индикаторы: дифениламин, ферроин и др.
Дихроматометрическое титрование применяют для определения восстановителей, некоторых окислителей, а также ионов, образующих малорастворимые в воде хроматы или дихроматы. Как и перманганатометрическое титрование дихроматометрия используется, главным образом, для определения неорганических веществ и сравнительно редко используется в фармацевтическом анализе.
Прямое дихроматометрическое титрование заключается в том, что раствор определяемого восстановителя подкисляют серной кислотой и титруют стандартным раствором K2Cr2O7, например:
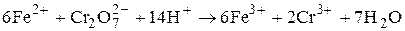
Если реакция окисления протекает медленно, используют обратное титрование. Раствор определяемого вещества кипятят с избытком стандартного раствора K2Cr2O7, а затем избыток титранта, не вступивший в реакцию, титруют стандартным раствором Fe2+ (соли Мора). Подобное дихроматометрическое титрование используется, например, при определении «химического потребления кислорода» (ХПК) — величины, характеризующей содержание органических веществ в воде. Химическим потреблением кислорода называют массу кислорода (мг) или окислителя в расчёте на кислород, необходимого для полного окисления, содержащихся в 1л данного образца воды органических веществ. ХПК имеет размерность мг/л. Для определения ХПК к пробе воды добавляют необходимое количество HgSO4 (для связывания хлорид-ионов, которые также могут окисляться дихроматом калия), H2SO4, Ag2SO4 (катализатор) и взятое в заведомом избытке точное количество стандартного раствора K2Cr2O7. Полученную смесь кипятят с обратным холодильником в течение 2-х часов. Затем раствор разбавляют водой и титруют непрореагировавший дихромат калия стандартным раствором Fe2+.
Дихроматометрическое титрование может быть использовано для определения некоторых необратимо восстанавливающихся окислителей, например, нитратов или хлоратов. К раствору, содержащему определяемое вещество, добавляется избыток стандартного раствора Fe2+. После проведения реакции оставшееся количество Fe2+ титруют стандартным раствором K2Cr2O7.
Дихроматометрическое титрование используется также как осадительное титрование для определения веществ, образующих малорастворимые в воде хроматы или дихроматы. К раствору, содержащему определяемый катион, добавляют избыток стандартного раствора дихромата калия. Выпавший осадок отфильтровывают, а в фильтрате определяют оставшееся количество K2Cr2O7 путём титрования стандартным раствором Fe2+ или иодометрически. Такой вариант титрования используется, например, для определения метиленового синего.
Дихроматометрическое титрование, или дихроматометрия, — метод определения веществ, основанный на реакции их окисления дихромат-ионами. Метод—фармакопейный.
Сущность метода. В основе метода лежит полуреакция.
Cr2О72? + 6e +14H+ =2Cr3+ + 7H2О Стандартный ОВ потенциал редокс-пары Cr2О72?, Н+/Сr3+ равен при комнатной температуре Е° = 1,36 В, т. е. имеет довольно высокое значение, поэтому дихромат-ионы способны окислять в кислой среде целый ряд веществ-восстановителей.
Реальный ОВ потенциал редокс-пары Cr2О72?, Н+/Сr3+ возрастает с повышением концентрации ионов водорода в соответствии с уравнением Нернста:
Е=Е°+(0,059/6)lg ([Cr2О72?], [Н+]14/[Сr3+]2),.
вследствие чего окислительная способность дихромат-иона увеличивается с понижением рН среды. Поэтому дихроматометрическое титрование обычно проводят в сильнокислых растворах.
Кислую среду можно создавать, прибавляя не только серную, но также ортофосфорную или хлороводородную кислоту; при концентрациях НС1, не превышающих 2 моль/л, хлорид-ионы не окисляются дихромат-ионами. При более высокой концентрации НС1 в растворе или при повышении температуры возможно частичное окисление хлорид-ионов дихромат-ионами до хлора, поэтому в этих условиях дихроматометрическое титрование в присутствии хлорид-ионов не проводят.
Титрант метода. Титрантом метода является водный раствор дихромата калия К2Cr2О7, чаще всего с молярной концентрацией эквивалента 0,1 моль/л. Титрант готовят по точной навеске дихромата калия высокой степени чистоты, предварительно дважды перекристаллизованного из воды и затем высушенного при ~150—200 °С. При хранении в закрытой емкости в темном месте раствор дихромата калия стабилен и не изменяет свой титр в течение длительного времени.
Фактор эквивалентности дихромата калия в соответствии с вышенаписанной полуреакцией равен 1/6; молярная масса эквивалента составляет М (1/6К2Cr2О7) = М (К2Cr2О7)/6 = 294,185/6 = 49,031 г/моль.
Определение конечной точки титрования. Водные растворы дихромата калия имеют оранжевую окраску, однако ее интенсивность недостаточна для надежного определения изменения цвета титруемого раствора в ТЭ. К тому же в ТЭ присутствуют катионы Сr3+, образовавшиеся при восстановлении дихромат-иона и обладающие зеленой окраской, что также затрудняет определение изменения цвета титруемого раствора в ТЭ. Поэтому дихроматометрическое титрование обычно проводят в присутствии редокс-индикаторов — дифениламина, дифениламинсульфоновой кислоты, N-фенилантраниловой кислоты.
Применение дихроматометрии. Прямым дихроматометрическим титрованием можно определять ряд восстановителей, таких, как железо (II) (включая определение ферроцианидов, содержащих ферроцианид-ион [Fe (CN)6]4?), сульфиты, иодиды, арсениты, аскорбиновую кислоту, метанол, суммы окисляющихся веществ в воде и почве и т. д. Методом обратного титрования определяют некоторые окислители. Так, определение железа (II) ведут прямым титрованием аликвоты анализируемого раствора стандартным раствором дихромата калия в кислой среде на основе реакции.
6Fe2+ + Cr2О72? +14H = 6Fe3+ +2Cr3+ + 7H2O.
При обратном дихроматометрическом определении окислителей, таких, как нитраты, хлораты, перманганаты и др., поступают следующим образом.
К аликвоте анализируемого раствора, содержащего определяемый окислитель, прибавляют известный избыток титрованного раствора железа (II). При этом железо (II) окисляется до железа (III), на что расходуется весь окислитель, присутствовавший в анализируемом растворе. Избыток не прореагировавшего железа (II) оттитровывают стандартным раствором дихромата калия, часто — в присутствии ортофосфорной кислоты для связывания образующегося железа (III) в фосфатные комплексы, вследствие чего реакция протекает с большей полнотой, а желтая окраска аква-комплексов железа (III) исчезает. Так можно определять нитраты:
NO3?+ 3Fe2+ + 4H+ = 3Fe3+ + NO + 2H2O.
Избыток железа (II) оттитровывают раствором дихромата калия:
6Fe2+ + Cr2О72? + 14Н+ = 6Fe3++ 2Cr3+ +7H2O избыток Аналогично определяют хлораты:
СlO3? + 6Fe2+ +6Н+ =6Fe3+ +Сl?+ 3Н2O.
6Fe2++ Cr2О72? + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O избыток '.
Методом обратного титрования определяют и некоторые восстановители, которые медленно реагируют с раствором дихромата калия. Так, например, при определении гидрохинона к аликвоте анализируемого раствора, содержащего гидрохинон, прибавляют известный избыток раствора дихромата калия и оставляют на некоторое время. Затем избыточный дихромат калия оттитровывают раствором, содержащим железо (II).
Общая оценка метода. Дихроматометрия в сравнении с перманганатометрией обладает как некоторыми преимуществами, так и недостатками.
К преимуществам можно отнести то, что стандартный раствор титранта готовится по точной навеске и не требует последующей стандартизации; титрант стабилен даже при длительном хранении; титрование можно проводить в соляно-кислой среде.
Недостатки: несколько меньший по сравнению с перманганат-ионом cтандартный OВ потенциал редокс-пары и в связи с этим более ограниченная возможность определения восстановителей; менее удобная фиксация КТТ, необходимость использования редокс-индикаторов.
Сущность броматометрического титрования Броматометрия является одним из методов редоксиметрического титрования. Основано на восстановлении бромат иона до бромид иона в кислой среде.
BrO3- +6H++6e>Br -+3H2O.
E° BrO3- / Br - =1,44 Вольт Бромат калия окисляет вещества стандартным потенциалом меньше одного вольта и отвечает требованиям стандарта. В качестве индикатора в броматометрии используют метилоранж или метилкрасный. Эти индикаторы окисляясь молекулярным бромом, обесцвечиваются. Для нужно чтобы в точке эквивалентности образовался молекулярный бром. Поэтому в титруемый раствор добавляют бромид калия который в кислой среде реагирует с первой избыточной каплей титранта, бромата калия и образует молекулярный бром.
Применение: Метод применяется при анализе лекарственных пре-паратов содержащих мышьяк, мышьяковистый ангидрид, новоарсенола осарсол и других форм ацевгич препаратов. Соединения мышьяка ядовиты. Требуется осторожность Пример: Определение мышьяковистого ангидрида.
3As2O3+2KBrO3+2HCl > 3As2O5+2KCl+2HBr.
As2O3 +2H2O-He > As2O5 +4H+
BrO3- +6H++Ge > Br-+3H2O.
ЭДС = E°- E°=1,44−0,56=0,886.
В точке эквивалентности лишняя капля титранта реагирует с бромид ионом образуя молекулярный бром в результате следующей реакции.
BrO3- +5Br-+6H+> 3Br2+3H2O.
ТKBrO3/As2O3 =0,14 946/ 1000= 0,4 946 г/см3
Смысл данной величины — число граммов мышьяковистого ангидрида которое оттитровывается, одним миллилитром титранта.
К= Nист/ Nтеор m As2O3 =KKBrO3 * ТKBrO3/As2O3 * VKBrO3
Бромометрическое титрование Основано на окислительно-восстановительной реакции:
Br2 + 2e> 2Br- E° Br2 /2Br- = 1,096.
В виду того, что раствор молекулярного брома не устойчив и токсичен применяют бромид — броматный способ бромометрического титрования, сущность которого сводится к следующему:
В титруемую солянокислую смесь добавляют избыток бромида калия.
KBrO3 + 5KBr + 6HCl > 3Br2 + 6KCl + 3H2O.
Выделившийся молекулярный бром служит титрантом окислителем для титруемого вещества. Именно поэтому метод называется бромид броматным способом бромометрического титрования, т. е. в отличие от броматометрии, где окислителем является бромат калия, в бромометрии титрантом окислителем является молекулярный бром, образующийся в титруемой смеси. Количество затраченного молекулярного брома на окисление пропорционально количеству титранта бромата калия.
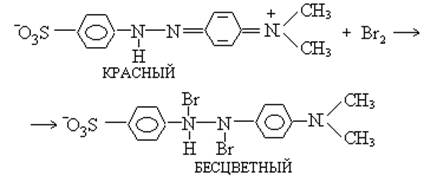
Применение бромометрии основано на реакции бромирования производных фенола:
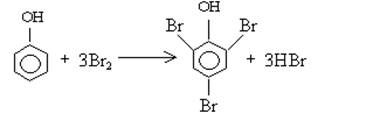
Сущность прямого бромометрического метода определения восстановителей: навеску анализируемого вещества растворяют в воде добавляют бромида калия и соляную кислоту титруют 0,1 н раствором бромата калия в присутствии индикатора метилоранжа при этом образующейся молекулярный бром тут же расходуется на окисление титруемого восстановителя и в точке эквивалентности когда заканчивается все количество восстановителя образующаяся очередная порция молекулярного брома обесцвечивает цвет индикатора метилоранжа.
Используют также обратное титрование. Определение салицилата натрия обратным броматометрическим титрованием — бромид-броматным способом.
В титруемый раствор добавляют отмеренное пипеткой мора избыточное количество бромата калия, бромида калия и соляную кислоту.
Смесь выдерживают 10 мин для протекания реакции бромирования.
Остаток молекулярного брома переводят в молекулярный йод, добавив в раствор йодид калия т.о. переведя остаток титранта -1, а именно молекулярный бром в молекулярный йод который оттитровывают тиосульфатом натрия. Поскольку среда кислая к тому же смесь содержит органические вещества невозможно использовать индикатор крахмал, поэтому в качестве индикаторной среды используют хлороформ.
Титрование продолжают до обесцвечивания малиновой окраски слоя хлороформа обусловленное восстановлением молекулярного йода (экстракт йода в хлороформе малинового цвета) тиосульфатом.
1. КBrO3+5КBr+6HCl> 3Br2+3H2O+6KCl.
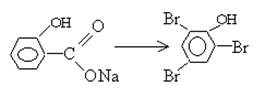
- 2. 3Br2 + + CO2^ + NaBr избыток
- 3. Br2 + 2KJ > 2КBr + J2 остаток
- 4. Реакция титрования J2 + 2Na2S2O3>2NaJ + Na2S4O6
Массу салицилата натрия в титруемой колбе рассчитывают по формуле:
mсалицилат натрия =.

Один моль салицилата натрия эквивалент трём молям молекулярного брома то есть шести атомом брома, поэтому при расчета эквивалента молярную массу салицилата натрия делят на шесть.
Дихроматометрическое титрование.
Основано на реакции восстановления дихромат иона.
Cr2O72-+14H++6e > 2Cr3++7H2O E°=1,36B.
Дихромат калия отвечает требованиям к стандартным веществам, поэтому его раствор готовят в мерной колбе и стандартизуют по точной навеске. Индикатор дифениламин, дифениламина сульфоновая кислота.
Применения дихроматометрии.
- 1. Используется для стандартизации титранта йодометрии — тиосульфата натрия.
- 2. Прямым титрованием определяют восстановители с Е <1в: гексацианоферрит, сульфит, хлорид ионы, железо (II), мышьяковистого ангидрида и метанола.
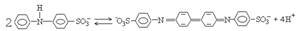
Количественное определение метанола:
Cr2O72-+CH3OH+8H+ > 2Cr3++CO2+6H2O индикатор дифениламино сульфоновая кислота.
Пример 2. Количественное определение нитратов методом титрования остатка.
- 3Fe2++NO3-+4H+ >3Fe3++NO+2H2O Избыток
- 6Fe2++Cr2O72-+14H > 6Fe3++2Cr3++7H2O Остаток
Индикатор йодокрахмальная бумага.
Cr2O72-+6J-+14H+ крахмал 3J2+2Cr3++7H2O.
В точке эквивалентности проба титруемого раствора, нанесенная на йодокрахмальную бумаги вызывает его окрашивание в синий цвет.
Процентное содержание нитратов вычисляют по формуле.
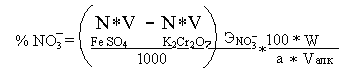
Литература
дихроматометрический титрование восстановитель окислитель.
- 1. Харитонов Ю. Я. «Аналитика. Аналитическая химия» , — М., «В.Ш.», ч. II, 2003 г., — с. 186−193.
- 2. Пономарев В. Д. «Аналитическая химия». — М., «В.Ш», ч. II, 1982 г. — с. 127−128.